Pada pembahasan
kali ini akan membahas tentang mekanisme reaksi-reaksi adisi pada aldehid dan
keton. Reaksi adisi merupakan reaksi pemutusan suatu ikatan rangkap atau
perubahan ikatan rangkap menjadi ikatan tunggal. Reaksi adisi digunakan untuk
membedakan alkena dan alkuna.
Reaksi adisi
nukleofilik pada aldehida dan keton, terdapat dua kemungkinan hasil reaksi:
a)
Intermediet
tetrahedral yang dapat diprotonasi dengan asam atau air menghsilkan alkohol.
b)
Atom
oksigen karbonil dapat dieliminasi sebagai OH atau H2O menghasilkan
ikatan rangkap C=Nu.
Senyawa keton
kurang reaktif terhadap nukleofilik dibandingkan aldehida. Ada 2 alasan utama perbedaan
reaktivitas aldehida dan keton, yaitu:
a.
Hambatan
sterik
Atom
karbonil pada keton lebih tertutup/sesak karena adanya gugus organik, sedangkan
pada aldehida lebih terbuka karena adanya satu gugus organik dan satu atom
hidrogen. Pada saat reaksi adisi nukleofilik kedua gugus pada aldehida (satu
gugus organik dan satu atom hidrogen) maupun keton (dua gugus organik)
didekatkan karena adanya perubahan hidridisasi dari sp2 ke sp3
dan sudut ikatan menurun dari 120° ke 109,5°. Dalam keadaan teregang (strain),
waktu yang digunakan untuk reaksi adisi pada aldehida lebih sedikit
dibandingkan keton karena salah satu gugus pada aldehida yaitu atom H berukuran
kecil.
Semakin
ke kanan maka hambatan sterik semakin berkurang di sekitar C=O, reaktivitas
untuk reaksi adisi semakin bertambah.
b.
Elektronik
Gugus
alkil biasanya bersifat pendonor elektron dibandingkan hidrogen, sehingga gugus
alkil cenderung lebih menetralkan muatan positif parsial pada karbon karbonil
yang kemudian menurunkan reaktivitasnya terhadap nukleofil. Keton memiliki dua
gugus alkil, sedangkan aldehida hanya memiliki satu gugus alkil.
1.
Reaksi Adisi
Nukleofilik Aldehida
Aldehid adalah
senyawa yang memiliki gugus karbonil yang terikat pada ujung molekulnya. Gugus
fungsi aldehid memiliki satu atom hidrogen yang terikat pada atom karbonil dan
gusus lain berupa gugus organik alifatik maupun aromatik. Rumus umum aldehid
adalah RCHO dengan gugus fungsinya –CHO. Aldehida paling sederhana yaitu
metanal (H2CO) atau disebut formaldehid.
Suatu pereaksi
akan masuk dalam ikatan rangkap karbonil. Pada senyawa karbonil terjadi
hidrogenasi yang menyebabkan aldehida direduksi menjadi alkohol primer.
Pada reaksi ini
, aldehida bereaksi lebih cepat dan lebih sempurna dibandingkan keton.
Perbedaan kereaktifan disebabkan karena keton lebih stabil daripada aldehida.
Stabilitas keton lebih besar disebabkan adanya delokalisasi muatan positif
karbon karbonil secara industri. Karbon karbonil aldehida lebih terbuka dan
hasil reaksi adisinya memiliki hambatan sterik yang lemah.
a.
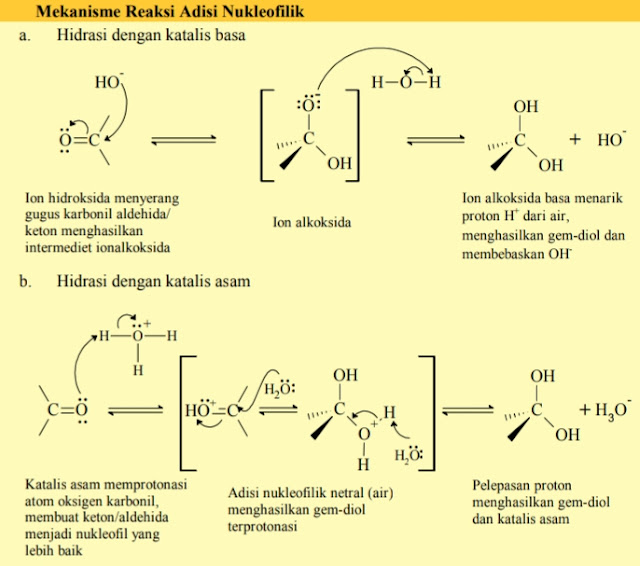
Adisi Air (Hidrasi)
Adisi
air pada aldehida dapat dikatalis dengan asam maupun basa. Air adalah nukleofil
lemah,maka diperlukan sedikit asam/basa sebagai katalis agar terjadi adisi pada
gugus karbonil. Reaksi ini bersifat reversibel. Aldehid paling reaktif yang
dapat membentuk hidrat stabil seperti formaldehida dan kloral.
Air
bereaksi dengan aldehida terbentuk hidrat RCHO.H2O atau RC(OH)2H.
Hidrat ini merupakan hidrosil pada atom karbon yang sama. Gem-diol dapat
mengeluarkan molekul air menjadi aldehida/keton. Contoh : larutan formaldehida
mengandung 99,9% gem-diol dan 0,1% aldehida. Hal ini dikarenakan terdapat
perbedaan dengan senyawa keton yang mengandung sedikit gem-diol.
Mekanisme
reaksi adisi air pada aldehida adalah sebagai berikut:
b.
Adisi Alkohol
Adisi
alkohol pada aldehida menggunakan asam sebagai katalis karena alkohol adalah
nukleofil lemah. Hasil adisi 1 molekul alkohol dalam 1 molekul aldehida
merupakan hemiasetal, yaitu senyawa
yang memiliki gugus –OH dan –OR dalam satu karbon.
Adisi
dari mol pertama R’OH :
Hemiasetal
dihasilkan yang bereaksi dengan alkohol menghasilkan asetal, suatu senyawa dengan dua gugus –OR terikat dengan satu
karbon.
Substitusi
dari mol kedua R’OH :
Rumus
umum pembuatan hemiasetal dan asetal :
c.
Adisi Hidrogen Sianida
Hidrogen
sianida adalah asam lemah, berwujud cairan/gas beracun pada temperatur kamar.
Senyawa aldehida bereaksi dengan HCN dihasilkan senyawa sianohidrin, suatu
senyawa dengan –OH dan –CN yang terikat pada satu atom karbon sama. Reaksi ini
menggunakan katalis basa.
Tahap
pembuatan HCN :
1.
Pembuatan
HCN
2.
Adisi
ion sianida
3.
Pembuatan
sianohodrin
d.
Adisi dari
Reagen Grignard
Senyawa
aldehida direaksikan dengan pereagen Grignard (RMgX) menghasilkan alkohol.
Reagen grignard adalah nukleofil kuat bila direaksikan dengan aldehida
menghasilkan alkoksida. Kemudian penambahan asam pada alkoksida dihasilkan
alkohol.
Reagen
grignard bereaksi dengan formaldehida menghasilkan alkohol primer, sedangkan
reagen grignard bereaksi dengan aldehida menghasilkan alkohol sekunder.
e.
Adisi Nitrogen
Amina,
amonia dan senyawa tertentu memiliki pasangan elektron bebas pada atom nitrogen
dan bertindak sebagai nukleofil nitrogen terhadap atom karbon karbonil. Reaksi
adisi nukleofilik amina primer dengan aldehida menghasilkan senyawa imina (R2C=NR).
Sedangkan reaksi adisi amina sekunder dengan aldehida/keton menghasilkan
senyawa enamina (R2N-CR=CR2).
f.
Adisi Hidrazina
(Reaksi Wolf-Kishner)
Jika
aldehida direaksikan dengan hidraliza (KOH) pada suhu 240°C akan dihasilkan
alkana.
Reaksi
Wolf-Kishner terjadi melalui pembentukan intermediet hidrazon (R2C=NNH2)
diikuti perpindahan ikatan rangkap dengan melepaskan gas N2 dan
dihasilkan alkana. Perpindahan ikatan rangkap terjadi bila basa menarik satu proton
dari NH menghasilkan anion hidrazon.
g.
Adisi Ylida
Fosforus (Reaksi Wittig)
Aldehida
diubah menjadi alkena dengan reaksi wittig. Reaksi wittig adalah reaksi pembuatan
ikatan karbon-karbon dengan cara mengubah ikatan rangkap dua (karbon-oksigen)
menjadi ikatan rangkap dua (karbon-karbon). Pereaksi wittig merupakan senyawa
yang mengandung fosfor (ylida fosforus) dengan rumus senyawa R2CP+(C6H5)3
atau disebut fosforan.
2.
Reaksi Adisi
Nukleofilik Keton
Keton adalah
senyawa organik yang memiliki sebuag gugus karbonil terikat pada dua gugus
alkil, dua gugus aril atau sebuah gugus alkil dan gugus aril. Keton tidak
memiliki atom hidrogen yang terikat pada gugus karbonil. Keton memiliki rumus
umum RC(O)R.
Senyawa karbonil
yang terjadi reaksi hidrogenasi menyebabkan keton direduksi menjadi alkohol
sekunder. Reaksi umumnya yaitu :
a.
Adisi Hidrasi
Keton
mengalami reaksi hidrasi membentuk hidrat RC(O)R.H2O atau RC(OH)2R.
Reaksi yangterjadi bersifat reversibel dan gem-diol dapat mengeluarkan molekul
air manjadi keton. Pada keton hanya mengandung sedikit gem-diol. Contohnya,
larutan aseton mengandung 0,1% gem-diol dan 99,9% keton.
b.
Adisi Alkohol
Apabila
senyawa keton direaksikan dengan alkohol maka menghasilkan produk disebut
asetal dan R2(COR’)2 disebut ketal.
Reaksi
umum pembuatan hemiasetal dan asetal pada keton:
c.
Adisi Hidrogen
Sianida
Keton
mengalami reaksi adisi dengan hidrogen sianida menghasilkan sianohidrin, yaitu
senyawa dengan gugus hidroksil dan gugus siano yang melekat pada atom karbon
sama. Reaksi ini berlangsung dengan katalis basa.
Tahap
pembuatan sianohidrin pada keton, yaitu:
1.
Pembuatan
HCN
2.
Adisi
ion sianida
3.
Pembuatan
sianohodrin
Contoh
pembuatan sianohidrin pada aseton:
d.
Adisi dari
Reagen Grignard
Adisi
pereaksi Grignard dengan keton menghasilkan alkohol. Reaksi ini terdiri dari 2
langkah:
1.
Pereaksi
Grignard mengadisi senyawa karbonil dan menghasilkan alkoksida.
2.
Alkoksida
dihidrolisis dalam suasana asam menghasilkan alkohol.
Senyawa
keton direaksikan dengan pereagen Grignard menghasilkan alkohol tersier.
e.
Adisi Nitrogen
Imina
dihasilkan dari adisi nukleofilik amina primer dengan keton. Sedangkan reaksi
adisi amina sekunder dengan keton menghasilkan enamina.
Reaksi
amina primer dengan senyawa karboksil:
f.
Adisi Hidrazina
(Reaksi Wolff-Kishner)
Reaksi
Wolff-Kishner digunakan pada senyawa aril keton. Metode Chemmensen juga dapat digunakan untuk mengubah gugus ketonmenjadi
alkana. Namun reaksi Wolff-Kishner lebih sering digunakan untuk senyawa alkil
maupun aril keton.
Reaksi
reduksi Chemmensen direaksikan dengan senyawa Zn(Hg) dan HCl pekat bersifat
kompleks.
g.
Adisi Ylide
Fosforus (Reaksi Wittig)
Reaksi
wittig dapat merubah keton menjadi alkena. Alkena dengan mono, di dan tri-substitusi dibuat dari kombinasi
senyawa organik-fosfor yang sesuai dengan senyawa keton. Alkena tetra-substitusi tidak dapat dibuat
karna faktor sterik. Reaksi wittig sangat bermanfaat untuk menghasilkan senyawa
alkena murni dikarenakan jika menggunakan pereaksi lain hasilnya berupa
campuran. Contohnya, reaksi antara sikloheksanon dengan metil entrifenil fosforan
hanya menghasilkan satu produk metil ensiklo heksana, sedangkan jika direaksikan
dengan metil magnesium bromida dan POCl3 menghasilkan produk
campuran.
Permasalahan:
- Apa yang akan terjadi jika reaksi adisi alkohol pada aldehida bila menggunakan katalis basa?
- Apa
yang menyebabkan reagen Grignard direaksikan dengan aldehida menghasilkan
alkohol sekunder?
- Mengapa
faktor sterik pada reaksi wittig terhadap keton menyebabkan tidak dapat
dibuatnya alkena tetra-substitusi?